Контакт:Ерол Джоу (г-н)
Тел: плюс 86-551-65523315
Мобилно/WhatsApp: плюс 86 17705606359
QQ:196299583
Skype:lucytoday@hotmail.com
Електронна поща:sales@homesunshinepharma.com
добавете:1002, Хуанмао Сграда, №105, Мънчън Път, Хефей Град, 230061, Китай
Scynexis е биотехнологична компания със седалище в Ню Джърси, САЩ, фокусирана върху разработването на иновативни терапии за преодоляване и предотвратяване на инфекции, които са трудни за лечение и резистентност. Наскоро компанията обяви положителните резултати в най-добрите линии на новото широкоспектърно противогъбично лекарство ibrexafungerp фаза III VANISH-306.
Това проучване изследва ефикасността и безопасността на пероралния ибрексафунгерп при лечението на вулвовагинална кандидоза (VVC). Резултатите показват, че ibrexafungerp има високо статистическо предимство, безопасност и поносимост по отношение на първичните и критичните вторични крайни точки в сравнение с плацебо. Положителните резултати от това проучване са в съответствие с докладваното по-рано фаза III VANISH-303 проучване. Първичните и критични вторични крайни точки в тези две ключови изпитвания на VANISH са необходими за регулаторно одобрение на индикациите за VVC и данните от проучването проправиха пътя за подаване на регулаторни документи за приложение за лечение с ibrexafungerp на VVC през втората половина на 2020 ,
ibrexafungerp е ново, широкоспектърно противогъбично лекарство и първият представител на тритерпеноидите, уникална структура на инхибитори на глюкан синтаза. ibrexafungerp съчетава добрата активност на инхибиторите на глюкан синтаза с потенциалната гъвкавост при перорално и интравенозно приложение. В момента лекарството се разработва за лечение на гъбични инфекции, причинени от Candida (включително Candida auris, C. auris) и Aspergillus. Проучвания in vitro и in vivo, лекарството показва широкоспектърна противогъбична активност срещу различни лекарствено-устойчиви патогени (включително щамове, резистентни на азол и ехинокандини).
Обявяването на резултатите от върховата линия на VANISH-306 бележи успешното завършване на проекта VANISH Phase III. Scynexis планира да представи ново заявление за лекарства (NDA) в Агенцията по храните и лекарствата на САЩ (FDA) по-късно тази година. Ако бъде одобрен, ibrexafungerp ще бъде първото и единствено орално неазолно лекарство, използвано за лечение на вагинални дрождови инфекции. Вагиналната мая инфекция е заболяване, което може да засегне до три четвърти от жените през целия живот, но възможностите за лечение са ограничени и не е одобрено ново лечение за повече от 20 години. Положителните резултати от проекта VANISH показват, че ibrexafungerp има потенциал да разреши вагинални дрождови инфекции с широк диапазон на тежест на заболяването. Лекарството ще бъде идеална възможност за лечение, особено за пациенти, които в момента са недоволни от съществуващите терапии.
David Angulo, MD, главен медицински лекар на Scynexis, каза: 0010010 "; Ние сме развълнувани от резултатите от VANISH-306, което е в съответствие с докладваното по-рано проучване VANISH-303, подкрепящо ефикасността на оралния ibrexafungerp, тъй като ново лечение за вагинални дрожди инфекции И безопасност. Две проучвания на VANISH фаза III също потвърдиха устойчивия клиничен ефект на ibrexafungerp по време на 25 дни след проследяване, което е в съответствие с резултатите от фаза IIb DOVE проучване. В същото време ние продължаваме да напредваме в проучването CANDLE фаза III, за да тестваме перорална превенция на ibrexafungerp Рецидивираща вагинална дрождова инфекция (понастоящем няма одобрено лечение) и се очаква да докладваме най-новите данни за тази индикация през втората половина на { . {5}} 0010010 quot;
Вулвовагинална кандидоза (VVC), широко известна като вагинална мая инфекция, причинена от Candida, е втората най-често срещана причина за вагинит. Въпреки че тези инфекции обикновено се причиняват от Candida albicans, резистентните към флуконазол щамове, като Candida glabrata, се съобщават за все по-често срещани. VVC може да причини тежка заболеваемост, включително тежък генитален дискомфорт, намалено сексуално удоволствие, психологически дистрес и загуба на производителност. Типичните симптоми на VVC включват сърбеж, вагинална болезненост, дразнене, загуба на вагиналната лигавица и ненормални вагинални секрети.
Смята се, че 70-75% от жените по света ще имат поне един епизод на VVC през живота си, а 40-50% от жените ще преживеят два или повече епизода на VVC. Около 6-8% от пациентите с VVC имат рецидивиращо заболяване, което се дефинира като поне три епизода на 12 месеца.
Понастоящем лечението на VVC включва няколко локални азолни противогъбични лекарства (клотримазол, миконазол и др.) И флуконазол, като последният в момента е единственото перорално противогъбично лекарство, одобрено за лечение на VVC в Съединените щати. Флуконазол съобщава за 55% процент на втвърдяване на етикета си и сега включва предупреждения за потенциално увреждане на плода, което показва необходимостта от нови алтернативни орални алтернативи. Пероралният флуконазол или лекарствата за локално приложение не могат напълно да задоволят нуждите на пациентите с умерен до тежък VVC, повтарящ се VVC, VVC, причинен от антифлуконазол Candida, и VVC в детеродна възраст. В допълнение, няма перорални заместители на пациенти с флуороконазол, които не реагират или не понасят лечение с VVC, нито има одобрени от FDA продукти, за да се предотврати рецидивиращият VVC.
ibrexafungerp е ново, широкоспектърно противогъбично лекарство и първият представител на тритерпеноидите, уникална структура на инхибитори на глюкан синтаза. ibrexafungerp съчетава добрата активност на инхибиторите на глюкан синтаза с потенциалната гъвкавост при перорално и интравенозно приложение. В момента лекарството се разработва за лечение на гъбични инфекции, причинени от Candida (включително Candida auris, C. auris) и Aspergillus. Проучвания in vitro и in vivo, лекарството показва широкоспектърна противогъбична активност срещу различни лекарствено-устойчиви патогени (включително щамове, резистентни на азол и ехинокандини). Преди това американската FDA е предоставила ibrexafungerp орални и интравенозни препарати за лечение на инвазивна кандидоза (IC, включително кандидемия), инвазивна аспергилоза (IA) и вулвовагинална кандидоза (VVC). QIDP) и бърза квалификация (FTD) и получи квалификация за лекарства сираци (ODD) за лечение на показания за IC и IA. ibrexafungerp по-рано се нарича SCY-078.
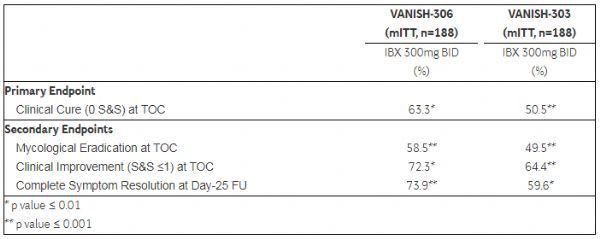
Резултати от проучването VANISH - {{3}} 06: (1) {{2}}. {{3}}% от лекуваните с ibrexafungerp пациенти достигнаха основната крайна точка на клиничното лечение при 1 0-ия ден от посещението на теста за лечение (TOC). Клиничното излекуване беше определено като един ден След 600 mg доза режим (две дози {{3}} 00 mg, приети 1 2 часа разделно), всички вагинални признаци и симптоми (S 00 1 00 1 0 amp; S) напълно изчезнаха. (2) {{1 3}}. {{1 4}}% от пациентите, лекувани с ibrexafungerp, достигат вторичната крайна точка на премахване на гъбички при посещението на TOC, т.е. отрицателна култура. ({{3}}) 7 2. {{3}}% от пациентите, лекувани с ibrexafungerp, бяха класифицирани като клинично подобрени при посещението на TOC, определени като пълен признак и симптом резултат 0 или 1. (4) 7 {{3}}. 9% от пациентите напълно изчезнаха на 2 {{1 4}} първия ден от посещението ,
Резултати за безопасност: В проучването VANISH-306, пероралният ibrexafungerp като цяло е безопасен и се понася добре. Сериозните нежелани събития (SAE) са редки и няма SAE, свързани с лекарства. Подобно на предишните проучвания, повечето от нежеланите събития, предизвикани от лечението (TEAE), настъпили с по-висока честота в групата за лечение с ibrexafungerp, наблюдавани в проучването VANISH-306, по същество са били стомашно-чревни (GI) събития, от които три най-чести стомашно-чревни събития (диария / изпражнения, гадене, коремна болка) бяха {{{4}}. 4%, 8. 4%, и 2. {{ 9}}%, съответно. Повечето от тези събития са леки, с кратка продължителност и не водят до прекратяване, което потвърждава добре поносимия преди това спазен еднодневен 600 mg перорален ибрексафунгерп режим.
Съвместната база данни за безопасност на пациенти с VVC в проектите VANISH и DOVE понастоящем включва повече от 850 записани пациенти, от които 575 пациенти са получавали единичен дневен 600 mg ibrexafungerp план за лечение. В общата база данни общата честота на най-често срещаните стомашно-чревни събития при пациенти, лекувани с ibrexafungerp, беше 16. 7% за диария / рядък изпражнения, {{{{{}}}} {{{ 6}}% за гадене и 4. 5% за коремна болка. Данните подкрепят добрата безопасност и поносимостта на ibrexafungerp. (Bioon.com)